اتمی، ساختار
اَتُمی، ساختار (atomic structure)
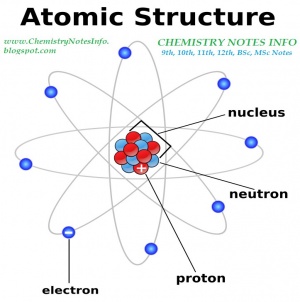
هسته[۱] که بخش مرکزی اتم را تشکیل میدهد، بخشی بسیار چگال و قطر آن فقط در حدود یک دههزارم قطر اتم است. سادهترین هسته، هستۀ اتم هیدروژن است که از یک تکذرۀ پایدار و دارای بار مثبت، با نام پروتون[۲]، تشکیل میشود. هستههای عناصر دیگر شامل پروتونهای بیشتر و ذرات دیگری با نام نوترون[۳]اند. جرم نوترون در حدود جرم پروتون است، ولی بار الکتریکی ندارد. هریک از عناصر هستۀ خاص خود را دارد. هستۀ هر عنصر تعداد معینی پروتون دارد که مشخصۀ آن شمرده میشود و عدد اتمی[۴] آن عنصر یا هسته است. تعداد نوترونهای موجود در هستۀ هر عنصر ممکن است ثابت نباشد. اتمهای یک عنصر منفرد را، وقتیکه تعداد نوترونهای درون هستهاش با هم تفاوت داشته باشد، ایزوتوپ[۵]های مختلف آن عنصر میگویند. هرچند که بعضی ایزوتوپها ممکن است ناپایدار باشند و خاصیت پرتوزایی[۶] از خود نشان دهند، اما خواص شیمیایی همۀ ایزوتوپهای یک عنصر معین هیچ فرقی با هم ندارند.
الکترون. هر هسته را تعدادی الکترون متحرک احاطه میکند. الکترونها بار الکتریکی منفی دارند. مقدار بار منفی هر الکترون با مقدار بار مثبت هر پروتون برابر است، اما جرم هر الکترون فقط در حدود ۲۸۳۶/۱ جرم پروتون است. در هر اتم خنثی، تعداد الکترونهایی که در اطراف هسته قرار دارند، دقیقاً برابر تعداد پروتونهای موجود در هسته است. بنابر نظریۀ کوانتومی[۷]، الکترون جای معینی ندارد و ممکن است در هر مکانی یافت شود، اما احتمال وجود آن در بعضی جاها بیشتر از جاهای دیگر است. ناحیهای از فضا را که احتمال وجود الکترون در آن به حداکثر میرسد، اربیتال[۸] میگویند. خواص شیمیایی هر عنصر با میزان سهولت الکترونگیری یا الکتروندهی آن عنصر مشخص میشود.
جاذبه و دافعه. انسجام اتمها را نیروی جاذبۀ الکتریکی، بین الکترونهای اطراف هسته و پروتونهای درون هسته، برقرار نگه میدارد. انسجام هسته بر اثر نیروی جاذبهای حفظ میشود که از نیروی دافعۀ الکتریکی قویتر است. این نیرو، که نیروی هستهای قوی[۹] نامیده میشود، پروتونها و نوترونهای درون هسته را به هم پیوند میدهد. نیروی قوی فقط در بردهای کوتاه عمل میکند، بهطوری که نوترونها و پروتونها برای آنکه جذب یکدیگر شوند عملاً باید در تماس باشند (← نیروهای_بنیادی). بنابراین، اگر بخشی از هسته، که شامل چند پروتون است، اندکی از گروه اصلی پروتونها و نوترونهای درون هسته فاصله بگیرد، دافعۀ طبیعی بین پروتونها این بخش را با سرعت زیاد از بقیۀ هسته دور خواهد کرد. این گونه پارش[۱۰] و تقسیم هستههای اتم، منجر به آزادسازی انرژی هستهای میشود.
دو نظریه از یونان باستان. در میان یونانیان باستان دو نظریه دربارۀ ماهیت ماده رواج داشت. برخی، مثل آناکساگوراس[۱۱] و ارسطو، ماده را پیوسته و نامتناهی میدانستند. طبق این نظریه، هر عنصر را بهطور نظری میتوان بینهایت بار تقسیم کرد. دیگران، مثل دموکریتوس[۱۲] و اپیکوروس[۱۳]، ماده را «دانهای» درنظر میگرفتند و آن را متشکل از ذرات بسیار ریز تقسیمناپذیر میدانستند. هیچ یک از این دو نظر، بر مبانی تجربی چندانی در طبیعت استوار نبود. پایستگی (بقای) ماده[۱۴]. پیشرفت شیمی تجربی در اواخر قرن ۱۸، منجر به لزوم دقت بیشتر در تعیین کمیتها شد و شواهد تجربی، که عمدتاً از مطالعات احتراق حاصل میشد، دانشمندان را به اصل پایستگی (بقای) ماده رهنمون شد. این اصل، بهویژه از لحاظ آشکارسازی عناصر جدید، بسیار ارزشمند بوده است.
نظریۀ دالتون. در قرن ۱۹، جان دالتون[۱۵] گازها را متشکل از ذرات میدانست. به این ترتیب، لازم بود هر جسم مرکب بهصورت ذرات اتمی به اتمهای سازندهاش قابل تقسیم باشد. دالتون قانون نسبتهای ثابت[۱۶] را به این شرح توصیف کرد: هنگامیکه از ترکیب دو عنصر جسم مرکبی ساخته میشود، نسبت این دو عنصر همیشه ثابت است و یکی از مشخصههای جسم مرکب بهشمار میرود. مثلاً، در ترکیب اکسیژن و هیدروژن و تشکیل آب، نسبت وزنی عناصر اکسیژن و هیدروژن همیشه مقدار ثابتی است.
تعیین وزن اتمی عناصر. بلافاصله بعد از اعلام نظریۀ اتمی دالتون، ژوزف گیلوساک[۱۷] شرایط حجمی گازهای ترکیبشونده را بررسی کرد. نتیجۀ تحقیق گیلوساک، کشف و طرح این قانون بود که در ترکیب گازها، حجم گازهای ترکیبشونده و حجم محصول، اگر به صورت گاز باشد، نسبتهای سادهای با یکدیگر دارند. در ۱۸۱۱، آمادئو آووگادرو فرضیهاش را دربارۀ اجزای مولکولی گازها منتشر کرد. بنابر فرضیۀ آووگادرو، در شرایط یکسان دما و فشار، تعداد مولکولهای موجود در حجمهای یکسان گازهای متفاوت با هم برابر است و بستگی به این ندارد که مولکولها از اتمهای منفرد یا از اتمهای بسیار متعدد ساخته شده باشند. شواهد تجربی هر دو فرضیه را به خوبی تأیید کرد و دانشمندان این دو فرضیه را برای تعیین جرم اتمی نسبی عناصر شیمیایی به کار بردند. بیشتر پیشرفتهایی که در شیمی حاصل شد، بر اساس تجزیۀ کیفی، و استفاده از وزنهای اتمی استوار بوده است.
رادرفورد و موزلی. در حدود ۱۹۰۰، مشخص شده بود که اتمها ساختاری داخلی دارند و تقسیمناپذیر نیستند. ارنست رادرفورد و دیگران (۱۹۱۱ـ۱۹۱۳) با استفاده از آزمایشهای ذرات آلفا[۱۸]، نشان دادند که عملاً همۀ جرم هر اتم در هستۀ مرکزی فوقالعاده کوچکی متمرکز شده است که بار الکتریکی مثبت دارد. در۱۹۱۳، رادرفورد با همکاری هنری موزلی[۱۹] نشان داد که هر هسته شامل تعدادی بار مثبت است و این تعداد بستگی به عنصر مورد نظر دارد. تعداد بار مثبت در هستۀ هر عنصر را عدد اتمی آن عنصر میگویند. در اطراف هسته و در فاصلۀ نسبتاً دور از آن، به تعداد پروتونها الکترون در گردش است. سبکترین هسته، که هستۀ اتم هیدروژن است، یک بار مثبت منفرد، با نام پروتون، دارد.
بور. در ۱۹۱۳، نیلس بور[۲۰] این نظریه را مطرح کرد که الکترونها، مانند سیاراتی که به دور خورشید در گردشاند، در مدارهایی به دور هسته حرکت میکنند. همچنین، او چگونگی جذب و نشر نور را در اتمها شرح داد. بور و دیگران این نظریات را با استفاده از نظریۀ کوانتومی گسترش دادند و آنها را با موفقیت تمام، برای توصیف کامل ساختار اتمی و توضیح خواص تودهای ماده و زیرساختار هسته به کار گرفتند.
چادویک. در ۱۹۳۲، جیمز چادویک[۲۱] کشف کرد که درپی بمباران برلیوم با ذرات آلفا، ذرات خنثایی حاصل میشوند که او آنها را نوترون نامید. باتوجه به وزن اتمی اتمها و وزن شناخته شدۀ پروتون و الکترون، معلوم شده که پروتونها و نوترونها اساساً جرمهای یکسانی دارند و تعداد نوترونها و پروتونهای موجود در هر هسته، تقریباً با هم مساوی است و بار هسته را پروتونها تأمین میکنند.
ذرات زیر اتمی. در پژوهشهای فیزیک انرژی زیاد، به وجود ذرات زیراتمی دیگری جز پروتون، نوترون، و الکترون نیز پی بردهاند (← فیزیک_ذرات). تاکنون بیش از ۳۰۰ نوع ذره را شناسایی و آنها را بر اساس جرم، بار الکتریکی، اسپین، گشتاور مغناطیسی، و برهمکنشهایشان در چند رده دستهبندی کردهاند. ذرات بنیادی[۲۲] را، که الکترون یکی از آنهاست، میتوان تقسیمناپذیر و سنگ بنای ماده تلقی کرد. هادرون[۲۳]هایی مانند پروتون و نوترون ذرات مرکبیاند که از دو یا سه ذرۀ بنیادی، با نام کوارک[۲۴]، تشکیل میشوند.
- ↑ nucleus
- ↑ proton
- ↑ neutron
- ↑ atomic number
- ↑ isotope
- ↑ radioactivity
- ↑ quantum theory
- ↑ orbital
- ↑ strong nuclear force
- ↑ fragmentation
- ↑ Anaxagoras
- ↑ Democritus
- ↑ Epicurus
- ↑ conservation of matter
- ↑ John Dalton
- ↑ the law of constant proportions
- ↑ Joseph Gay-Lussac
- ↑ α-particles
- ↑ Henry Moseley
- ↑ Niels Bohr
- ↑ James Chadwick
- ↑ elementary particles
- ↑ hadron
- ↑ quark
