باتری
باتری (battery)



اسبابی برای ذخیرۀ انرژی. این وسیله در وقتِ لزوم انرژی را بهشکل الکتریسیته آزاد میکند. از یک یا چند سلّول[۱] الکتریکی ساخته شده است و الکتریسیته براثر واکنش شیمیایی در سلولها تولید میشود. دو نوع باتری وجود دارد: پیل ساده که یکبار مصرف است، و باتریهای بارشدنی یا انباره که قابل پُر شدناند. شکل تولیدِ انرژی در پیلِ ساده اصلاً باصرفه نیست، زیرا فقط دو درصد از انرژیی را که در ساختشان بهکار رفته است تولید میکنند. تلاش برای پُر کردن پیلهای ساده هم خطرناک است.
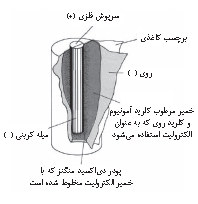
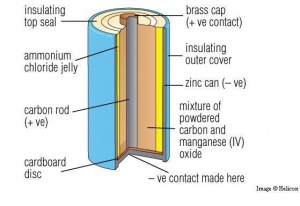
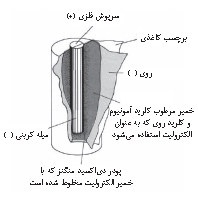
پیل ساده. پیل خشک[۲] معمولترین نوع پیل ساده است که براساس پیل لکلانشه[۳] ساخته میشود. پیل خشک باتریی است که برای برق رساندن به چراغقوهها، اسباببازیهای الکترونیکی، دستگاههای استریوی کوچک و مانند آنها بهکار میرود. پیل خشک متشکل از پوستهای از فلز روی است که الکترود[۴] منفی به شمار میآید، هستهای میلهای از کربن که در مرکز پوسته کار گذاشته شده است و الکترودِ مثبت است، و خمیری از دیاکسید منگنز و کلرید آمونیوم که الکترولیت[۵] پیل است و بین پوسته و هسته را فراگرفته است. تولید الکتریسیته در پیل به اختلاف الکترونگاتیویتۀ[۶] بین کربن و روی بستگی دارد: کربن الکترونهای خود را با قدرت حفظ میکند و الکترونگاتیوتر است. روی الکترونهایش سستترند و الکترونگاتیویتۀ کمتری دارد. روی در کلرید آمونیوم حل میشود و هر اتم آن دو الکترون ازدست میدهد. این الکترونها بهسمت الکترود کربن حرکت میکنند:
Zn → Zn۲++ ۲e-
به این ترتیب، مقدار اندکی بار ایجاد میشود. روی بار[۷] منفی و کربن بار مثبت میگیرد. وقتی اتصالی خارجی بین پایانۀ کربن مثبت و پایانۀ روی منفی ایجاد شود، الکترونها از الکترودِ روی بهسمت کربن جریان مییابند. به این ترتیب، بار هردو الکترود خنثی میشود و فلز روی بیشتری در الکترولیت حل، و الکترونهای بیشتری نیز تولید میشود. پیل خشک آنقدر جریان الکتریسیته تولید میکند تا الکترود روی کاملاً مصرف شود.
باتریهای بارشدنی. انباره یا پیلهای بارشدنی در زمانی کوتاه، انرژی زیادی ایجاد میکنند و قابلیت آن را دارند که دوباره پُر (شارژ) شوند. باتری سرب اسید اتومبیل باتری بارشدنیای با الکترولیتِ اسید سولفوریک (اسید باتری) است. پراکسید سرب الکترود مثبت، و سرب الکترود منفی آن را تشکیل میدهند. باتری معمولی سرب اسید از شش سلول سرب اسید در یک پوسته تشکیل شده است. هر سلول دو ولت برق، و بنابراین کل باتری جمعاً دوازده ولت برق تولید میکند. از ۱۹۹۶، استفاده از سلولهای هیدروژنی و باطریهای سدیم گوگرد توسعه یافت. اتومبیلهایی که همه نیروی خود را از این نوع باتری میگیرند تا ۱۶۰ کیلومتر کار میکنند. عرضۀ باتریهای پُرشدنی نیکل کادمیوم انقلابی در دستگاههای الکترونیکی قابل حمل خبرنگاری، ازجمله ضبط صوت، ویدیو و نیز در دادهپردازی و محاسبۀ رایانهای ایجاد کرد. این باتریها منبع انرژی پایدار، بینوسان، کوتاهمدت، بیصدا و بدون مخاطرات دیگر الکتریکیاند. برخی از ماشینهای الکترونیکی اکنون به باتریهائی با آندِ لیتیوم مجهزند. این باتریها حدود پنج سال دوام میآورند، اما نمیتوان آنها را دوباره پُر کرد. در مقابل، باتریهای جدید لیتیوم یونی، آند کربنی و کاتدهایی از ترکیب لیتیوم، کبالت، نیکل و منگنز دارند و الکترولیتشان آمیزهای از کربنات پروپیلین و دیاتیل کربنات است. این باتریها، در مقایسه با باتریهای نیکل کادمیم که ۱.۲ ولتیاند، ۳.۶ ولت برق تولید میکنند و میتوانند حدود ۱۲۰۰ مرتبه پُر شوند. اولین باتری پُرشدنی که از مواد جامد سبکوزن ساخته شده بود، در ۱۹۹۵ بهراه انداخته شد. شرکت امریکایی اولترا لایف[۸] این باتری را تولید کرد که شامل الکترودهایی با پایۀ لیتیوم و الکترولیت بسپار جامد با ساختاری فاش نشده است. این باتری برای استفاده در تجهیزات قابل حمل مانند، رایانۀ روزانویی[۹] و تلفنهای همراه، طراحی شده است و از آنجا که اجزاء جامد آن نشت نمیکنند ایمنتر است. در ژوئیه ۱۹۹۶ اولین باتری کاملاً پلاستیک در امریکا ساخته شد. در ۱۹۷۷، مخترع امریکایی این باتریها گونهای باتری پلاستیکی با اندازۀ کارت اعتباری را در بالتیمور مریلند عرضه کرد. این باتری ۲.۵ ولت الکتریسیته تولید میکند و فاقد مواد سمّیای است که ممکن است از باطریهای معمولی نشت کنند. نیز ← انباره_(فیزیک)
