استوالد، ویلهلم (۱۸۵۳ـ۱۹۳۳): تفاوت میان نسخهها
بدون خلاصۀ ویرایش |
Mohammadi2 (بحث | مشارکتها) بدون خلاصۀ ویرایش |
||
| (یک نسخهٔ میانیِ ایجادشده توسط همین کاربر نشان داده نشد) | |||
| خط ۱: | خط ۱: | ||
اُسْتْوالد، ویلهِلم (۱۸۵۳ـ۱۹۳۳)(Ostwald, Wilhelm)<br/> [[File:11275100-1.jpg|thumb|اُسْتْوالد، ويلهِلم]] {{جعبه زندگینامه | اُسْتْوالد، ویلهِلم (۱۸۵۳ـ۱۹۳۳)(Ostwald, Wilhelm)<br /> [[File:11275100-1.jpg|thumb|اُسْتْوالد، ويلهِلم]] {{جعبه زندگینامه | ||
|عنوان =ویلهلم استوالد | |عنوان =ویلهلم استوالد | ||
|نام =Wilhelm Ostwald | |نام =Wilhelm Ostwald | ||
| خط ۷: | خط ۷: | ||
|نام مستعار= | |نام مستعار= | ||
|لقب= | |لقب= | ||
|زادروز=۱۸۵۳م | |زادروز=ریگا ۱۸۵۳م | ||
|تاریخ مرگ=۱۹۳۳م | |تاریخ مرگ=۱۹۳۳م | ||
|دوره زندگی= | |دوره زندگی= | ||
| خط ۲۷: | خط ۲۷: | ||
|پست تخصصی = | |پست تخصصی = | ||
|باشگاه = | |باشگاه = | ||
}}شیمیدان آلمانی زادۀ لاتویا (لتونی)<ref>Latvia | }} | ||
[[پرونده:11275100-2.jpg|بندانگشتی|ویلهلم استوالد]] | |||
شیمیدان آلمانی زادۀ [[لاتویا]] (لتونی)<ref>Latvia | |||
</ref>. فرآیند استوالد<ref> Ostwald process </ref> (اکسیداسیون<ref>oxidation</ref> آمونیاک روی کاتالیزور پلاتین<ref> platinum | </ref>. فرآیند استوالد<ref> Ostwald process </ref> (اکسیداسیون<ref>oxidation</ref> آمونیاک روی کاتالیزور پلاتین<ref> platinum | ||
</ref> برای تولید اسید نیتریک<ref>nitric acid </ref>) را عرضه کرد. تحقیقاتش در زمینۀ کاتالیستها<ref>catalysts</ref> موجب شکلگیری صنعت پتروشیمی<ref> Petrochemical industry</ref> شد. جایزه نوبل شیمی ۱۹۰۹ بهسبب تحقیق در زمینۀ کاتالیستها، اصول تعادل، و سرعتهای واکنش به او اعطا شد. در ریگا<ref> Riga</ref> زاده شد و در دانشگاه دورپات<ref> Dorpat </ref> (تارتو<ref>Tartu</ref>) در استونی درس خواند. از ۱۸۸۱ تا ۱۸۸۷، در ریگا و از ۱۸۸۷ تا ۱۹۰۶، در لایپزیگ<ref> Leipzig </ref> استاد بود. از ۱۸۹۸، مدیر مؤسسۀ فیزیوشیمی لایپزیگ<ref>Leipzig's Physiochemical Institute</ref> بود. در ۱۸۸۸، قانون رقّت استوالد<ref> ostwald dilution law </ref> را عرضه کرد که نسبت درجۀ تفکیک<ref>degree of dissociation </ref> یک الکترولیت<ref>electrolyte </ref>، α، را نسبت به غلظت<ref>concentration</ref> کلی آن، C، بر حسب مول بر لیتر (dm<sup>۳</sup>) بیان میکند. این قانون چنین فرمولبندی میشود: | </ref> برای تولید [[نیتریک، اسید|اسید نیتریک]]<ref>nitric acid </ref>) را عرضه کرد. تحقیقاتش در زمینۀ کاتالیستها<ref>catalysts</ref> موجب شکلگیری صنعت پتروشیمی<ref> Petrochemical industry</ref> شد. جایزه نوبل شیمی ۱۹۰۹ بهسبب تحقیق در زمینۀ کاتالیستها، اصول تعادل، و سرعتهای واکنش به او اعطا شد. در [[ریگا]]<ref> Riga</ref> زاده شد و در دانشگاه دورپات<ref> Dorpat </ref> (تارتو<ref>Tartu</ref>) در استونی درس خواند. از ۱۸۸۱ تا ۱۸۸۷، در ریگا و از ۱۸۸۷ تا ۱۹۰۶، در [[لایپزیگ]]<ref> Leipzig </ref> استاد بود. از ۱۸۹۸، مدیر مؤسسۀ فیزیوشیمی لایپزیگ<ref>Leipzig's Physiochemical Institute</ref> بود. در ۱۸۸۸، قانون رقّت استوالد<ref> ostwald dilution law </ref> را عرضه کرد که نسبت درجۀ تفکیک<ref>degree of dissociation </ref> یک [[الکترولیت]]<ref>electrolyte </ref>، α، را نسبت به غلظت<ref>concentration</ref> کلی آن، C، بر حسب مول بر لیتر (dm<sup>۳</sup>) بیان میکند. این قانون چنین فرمولبندی میشود: (فرمول ۱) | ||
فرمول ۱:که در آن ثابت K مستقل از ضریب فعالیت<ref> activity coefficient </ref> است و از اینرو ثابت ترمودینامیکی<ref>thermodynamic constant </ref> واقعی نیست. این معادله از لحاظ تاریخی اهمیت دارد، زیرا در آن اثر جرم برای اولینبار در محلولهایی از اسیدها و بازهای آلی ضعیف لحاظ شد. استوالد سپس در زمینۀ نظریۀ شناساگرهای اسید ـ باز<ref>acid-base indicator</ref> به تحقیق پرداخت. از ۱۹۰۹، به جنبههای سازمانی و روششناسی<ref> methodology</ref> مفاهیم علم، زبان جهانی، و اینترناسیونالیسم و صلحطلبی علاقهمند شد. آزمایشگاهی نیز برای تحقیقات رنگ<ref> Colour research</ref> بنا کرد. | فرمول ۱:که در آن ثابت K مستقل از ضریب فعالیت<ref> activity coefficient </ref> است و از اینرو ثابت ترمودینامیکی<ref>thermodynamic constant </ref> واقعی نیست. این معادله از لحاظ تاریخی اهمیت دارد، زیرا در آن اثر جرم برای اولینبار در محلولهایی از اسیدها و بازهای آلی ضعیف لحاظ شد. استوالد سپس در زمینۀ نظریۀ شناساگرهای اسید ـ باز<ref>acid-base indicator</ref> به تحقیق پرداخت. از ۱۹۰۹، به جنبههای سازمانی و روششناسی<ref> methodology</ref> مفاهیم علم، زبان جهانی، و اینترناسیونالیسم و صلحطلبی علاقهمند شد. آزمایشگاهی نیز برای تحقیقات رنگ<ref> Colour research</ref> بنا کرد. | ||
<br /> | |||
---- | ---- | ||
[[Category:شیمی و بیوشیمی]] [[Category:(شیمی و بیوشیمی)اشخاص و آثار]] | [[Category:شیمی و بیوشیمی]] | ||
[[Category:(شیمی و بیوشیمی)اشخاص و آثار]] | |||
<references /> | |||
نسخهٔ کنونی تا ۲۸ فوریهٔ ۲۰۲۲، ساعت ۱۰:۵۹
اُسْتْوالد، ویلهِلم (۱۸۵۳ـ۱۹۳۳)(Ostwald, Wilhelm)
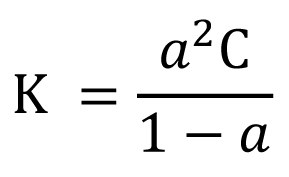
| ویلهلم استوالد Wilhelm Ostwald | |
|---|---|
| زادروز |
ریگا ۱۸۵۳م |
| درگذشت | ۱۹۳۳م |
| ملیت | آلمانی- لتونیایی |
| تحصیلات و محل تحصیل | دانشگاه دورپات (تارتو)- استونی |
| شغل و تخصص اصلی | شیمی دان |
| گروه مقاله | شیمی و بیوشیمی |

شیمیدان آلمانی زادۀ لاتویا (لتونی)[۱]. فرآیند استوالد[۲] (اکسیداسیون[۳] آمونیاک روی کاتالیزور پلاتین[۴] برای تولید اسید نیتریک[۵]) را عرضه کرد. تحقیقاتش در زمینۀ کاتالیستها[۶] موجب شکلگیری صنعت پتروشیمی[۷] شد. جایزه نوبل شیمی ۱۹۰۹ بهسبب تحقیق در زمینۀ کاتالیستها، اصول تعادل، و سرعتهای واکنش به او اعطا شد. در ریگا[۸] زاده شد و در دانشگاه دورپات[۹] (تارتو[۱۰]) در استونی درس خواند. از ۱۸۸۱ تا ۱۸۸۷، در ریگا و از ۱۸۸۷ تا ۱۹۰۶، در لایپزیگ[۱۱] استاد بود. از ۱۸۹۸، مدیر مؤسسۀ فیزیوشیمی لایپزیگ[۱۲] بود. در ۱۸۸۸، قانون رقّت استوالد[۱۳] را عرضه کرد که نسبت درجۀ تفکیک[۱۴] یک الکترولیت[۱۵]، α، را نسبت به غلظت[۱۶] کلی آن، C، بر حسب مول بر لیتر (dm۳) بیان میکند. این قانون چنین فرمولبندی میشود: (فرمول ۱)
فرمول ۱:که در آن ثابت K مستقل از ضریب فعالیت[۱۷] است و از اینرو ثابت ترمودینامیکی[۱۸] واقعی نیست. این معادله از لحاظ تاریخی اهمیت دارد، زیرا در آن اثر جرم برای اولینبار در محلولهایی از اسیدها و بازهای آلی ضعیف لحاظ شد. استوالد سپس در زمینۀ نظریۀ شناساگرهای اسید ـ باز[۱۹] به تحقیق پرداخت. از ۱۹۰۹، به جنبههای سازمانی و روششناسی[۲۰] مفاهیم علم، زبان جهانی، و اینترناسیونالیسم و صلحطلبی علاقهمند شد. آزمایشگاهی نیز برای تحقیقات رنگ[۲۱] بنا کرد.
- ↑ Latvia
- ↑ Ostwald process
- ↑ oxidation
- ↑ platinum
- ↑ nitric acid
- ↑ catalysts
- ↑ Petrochemical industry
- ↑ Riga
- ↑ Dorpat
- ↑ Tartu
- ↑ Leipzig
- ↑ Leipzig's Physiochemical Institute
- ↑ ostwald dilution law
- ↑ degree of dissociation
- ↑ electrolyte
- ↑ concentration
- ↑ activity coefficient
- ↑ thermodynamic constant
- ↑ acid-base indicator
- ↑ methodology
- ↑ Colour research
