مولکول
مولِکول (molecule)
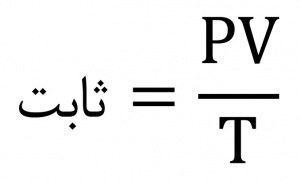
کوچکترین ذرۀ یک ترکیب یا یک عنصر که میتواند مستقلاً وجود داشته باشد. اتمهای هیدروژن در دمای اتاق نمیتوانند بهتنهایی وجود داشته باشند، لذا با یکدیگر ترکیب شده و هیدروژن مولکولی تولید میکنند. هر مولکول ترکیب دو یا چند اتم گوناگون است که با یکدیگر پیوند برقرار کردهاند. مولکولها، از مولکول هیدروژن (H۲) تا درشتمولکولها[۱]ی پروتئینی، از لحاظ اندازه و پیچیدگی با هم فرق دارند. مولکولها ممکن است از طریق پیوندهای یونی[۲] کنار هم قرار گیرند که در آن، اتمها برای تشکیل یونها یا الکترون میگیرند یا الکترون از دست میدهند. همچنین، مولکولها از طریق پیوندهای کئووالانی[۳] نیز تشکیل میشوند که در آن، الکترونهای هر اتم در یک اربیتال مولکولی جدید به اشتراک گذاشته میشوند. هر ترکیب با یک فرمول شیمیایی نشان داده میشود که نشانگر عناصری است که ترکیب میتواند به آنها شکسته شود. فرمول نوع و تعداد اتمها را نیز بیان میکند. نمایش سمبلیک یک مولکول به فرمول مولکولی[۴] معروف است. مثلاً مولکول آب دارای دو اتم هیدروژن و یک اتم اکسیژن است و آن را با H۲O نشان میدهند.
نظريۀ جنبشي ماده (نظریۀ جنبشی ماده[۵]). بنابه نظریۀ سینتیکی یا نظریۀ مولکولی ماده[۶]، ماده از مولکولهایی ساخته شده است که متحرکاند و مقدار این حرکت به دمای آنها بستگی دارد. مولکولها نیروهایی نیز برهم وارد میکنند. ماهیت و قدرت این نیروها بستگی به دما و حالت ماده (جامد، مایع، و گاز) دارد. برای اولینبار در ۱۸۱۱ بهواسطۀ فرضیه فیزیکدان ایتالیایی، آمادِئو آووگادرو[۷]، به موجودیت مولکولها پی برده شد. او مشاهده کرد که ترکیب گازها با نسبتهای سادهای صورت میگیرد. مثلاً یک حجم از اکسیژن با دو حجم از هیدروژن ترکیب میشود و آب را تولید میکند و فرض کرد در حجمهای مساوی از گازها در دما و فشار یکسان، تعداد مولکولها مساوی است. فرضیۀ آووگادرو[۸] در ۱۸۶۰ و زمانی قبول عام یافت که شیمیدان ایتالیایی، استانیسیلائو کانیتسارو[۹]، آن را پیش نهاد. جابهجایی برخی از مولکولها را میتوان با میکروسکوپ مشاهده کرد. در اوایل ۱۸۲۷، روبرت براون[۱۰] مشاهده کرد بسیاری از دانههای ریز گرده که در آب معلق بودند، نامنظم و پیدرپی حرکت میکنند. این جنبش تصادفی و مداوم ذرات در یک حلال مانند گاز یا مایع، بهطوری که ذرات در حال برخورد با مولکولهای حلال باشند، به حرکت براونی[۱۱] معروف است. این جابهجایی خودبهخودی و تصادفی مولکولها یا ذرات در یک حلال بهشکل نفوذ یا انتشار هم دیده میشود، بهطوری که ذرات از محلی با غلظت بالایی به محلی نفوذ میکنند که غلظت کمی دارد و این کار تا وقتی که غلظت یکنواختی در سراسر حلال پدید آید ادامه مییابد. در اینجا همزدن یا مخلوطکردن مکانیکی در نظر نیست. مثلاً اگر یک قطره جوهر به آب افزوده شود، مولکولهای جوهر در آب پراکنده میشوند تا وقتیکه جوهر بهصورت یکنواخت در سراسر حلال، در اینجا آب، پخش شود. نظریۀ جنبشی گازها[۱۲] اثر فشار، دما، و حجم بر گازها طی قرون ۱۷ و ۱۸ بررسی شد. براساس قانون بویل[۱۳]، برای جرم ثابتی از گاز، حجم گاز در دمای ثابت بهصورت معکوس با فشار متناسب است. بر اساس قانون شارل، برای جرم ثابتی از گاز، حجم گاز در فشار ثابت متناسب با دمای مطلق است. بنابه قانون فشار[۱۴]، فشار جرم ثابتی از گاز در حجم ثابت، مستقیماً متناسب با دمای مطلق آن است. مجموعه این قوانین به قوانین گازها معروفاند و به این صورت بیان میشوند: (فرمول ۱).
فرمول ۱:
نمودار حجم یک گاز براساس دمای آن خط راستی است که نشان میدهد این دو عامل با یکدیگر متناسباند. این خط محور ایکس را در ۲۷۳- درجۀ سانتیگراد قطع میکند. از اینرو، میتوان گفت اگر گاز در ابتدا بهشکل مایع نباشد، در دمای ۲۷۳- درجۀ سانتیگراد، حجم آن صفر خواهد بود. به این دما صفر مطلق یا صفر در مقیاس کلوین میگویند (۰K) و پایینترین دمای ممکن از لحاظ نظری است. چنین رفتاری فقط برای گازهای ایدهآل در نظر گرفته میشود. گازهای ایدهآل گازهاییاند که حجم ناچیزی را اشغال میکنند، بهقسمی که حجم قابل صرفنظر است و نیروهای بین ذرات نیز در آنها قابل چشمپوشی است. از آنجایی که گاز حقیقی رفتاری متفاوت با گازهای ایدهآل[۱۵] دارد، قانون واندروالس[۱۶] شامل فاکتور تصحیحی است که در قوانین گازها اعمال میشود تا رفتار غیر ایدهآل گازهای حقیقی[۱۷] را نیز بتوان محاسبه کرد.
تغییر حالت. وقتی ماده گرم شود، ممکن است دمای آن افزایش یابد که منجر به تغییر حالت آن ماده میشود. زمانی که انرژی درونی ماده زیاد میشود، انرژی گرفتهشدۀ هر ذره نیز افزایش مییابد، از اینرو، تحرک ذرات و انرژی سینیتکی ذرات بیشتر میشود. این تحرک و جابهجایی موجب تشدید ارتعاش و چرخش مولکولها میشود. در این حالت فرض بر این است که جسم بیش از یک اتم دارد. یک جامد از ذراتی تشکیل شده است که با نیروهایی در کنار هم قرار گرفتهاند .هنگامی که به جامدی حرارت میدهیم، ذرات آن بهشدت مرتعش میشوند و فضای بیشتری را اشغال میکنند. این امر منجر به انبساط ماده میشود .وقتی که دمای جامد افزایش یابد، ذرات آن به حالت مایع درمیآیند که در این حالت آزادی عمل بیشتری دارند، ولی به هر حال باز هم نیروهایی بین آنها وجود دارد .در صورتی که به ماده انرژی بیشتری داده شود، ذرات سریعتر حرکت میکنند تا بر این نیروها غلبه کنند. در نقطۀ جوش، مایع میجوشد و به گاز تبدیل میشود. ذرات گاز مستقل از هم حرکت میکنند، جز زمانی که با هم برخورد کنند .برای اینکه دمای اجسام به مقدار مشابهی تغییر کند، به مقدار انرژی گرمایی متفاوتی نیاز است. بهعبارت دیگر، اگر بخواهیم دمای چند شیء متفاوت را به یک مقدار مشابه بالا ببریم مقدار انرژیهای متفاوتی نیاز داریم. ظرفیت گرمایی[۱۸] یک شیء مقدار گرمایی است که دمای آن شیء را یک درجه افزایش میدهد. ظرفیت گرمایی ویژه[۱۹] یک جسم ظرفیت گرمایی در واحد جرم است و بر حسب ژول بر کیلوگرم کلوین اندازهگیری میشود. وقتیکه جسم حین گرمشدن تغییر حالت میدهد، دمای آن ثابت است، حتی اگر انرژی گرمایی بالا رود مثلاً آب در دمای ثابتی میجوشد و بخار میشود. انرژی لازم برای تغییر حالت یک جسم را گرمای پنهان[۲۰] میگویند. این انرژی برای غلبه بر نیروهای نگهدارندۀ ذرات بهکار میرود، بهطوری که با غلبه بر این نیروها تغییر حالت ماده رخ میدهد. گرمای پنهان ویژه[۲۱] انرژی گرمایی لازم برای تغییر حالت جرم معینی از مادهای خاص است، بدون اینکه دما تغییر کند. وقتیکه مایعی تبخیر شود، عمل تبخیر[۲۲] موجب خنکشدن مایع میگردد. جابهجایی ذرات بر اثر انرژی سینیتکی موجب میشود گرما از طریق هدایت[۲۳]، همرفت[۲۴] و تشعشع[۲۵] انتقال یابد. هدایت جابهجایی گرما در مادۀ جامد است و از طریق الکترونهای آزاد صورت میگیرد. همرفت انتقال انرژی از طریق جابهجایی ذرات است. جریانهای همرفتی[۲۶] براثر افزایش دمای مایعات و گازها و انبساط آنها ایجاد میشوند. مادۀ منبسطشده چگالی کمتری دارد و روی ماده سردتر و چگالتر قرار میگیرد.
اندازه و شکل مولکولها. شکل یک مولکول شدیداً بر خواص بیولوژیکی، فیزیکی، و شیمیایی آن اثر میگذارد. ایزومرهای نوری یا مولکولهایی که تصاویر آینهای هماند، صفحۀ نوری پلاریزه شده را در جهتهای مخالف هم میچرخانند. ایزومرهای مولکولهای دارویی ممکن است اثرات بیولوژیکی متفاوتی داشته باشند .واکنشهای آنزیمی شدیداً بهشکل آنزیم و جسمی بستگی دارد که آنزیم روی آن عمل میکند. شیمیدانهای آلمانی در۱۹۹۵، مولکولی دایرهایشکل شامل ۷۰۰ اتم ساختند که جرم مولکولی نسبی آن حدود ۲۴هزار بود. این مولکول دارای ۱۵۴ اتم مولیبدن[۲۷] بود که با اتمهای اکسیژن احاطه شده بودند و به طبقهای از ترکیبات با نام کلاسترهای فلزی تعلق داشت.
- ↑ macromolecules
- ↑ ionic bonds
- ↑ covalent bonds
- ↑ molecular formula
- ↑ Kinetic theory of matter
- ↑ molecular theory of matter
- ↑ Amedeo Avogadro
- ↑ Avogadro’s hypothesis
- ↑ Stanislao Cannizzaro
- ↑ Robert Brown
- ↑ Brownian movement
- ↑ Kinetic theory of gases
- ↑ Boyle’s Law
- ↑ pressure law
- ↑ Ideal gases
- ↑ van der Waals’ law
- ↑ real gases
- ↑ heat capacity
- ↑ specific heat capacity
- ↑ latent heat
- ↑ specific latent heat
- ↑ Evaporation
- ↑ conduction
- ↑ convection
- ↑ radiation
- ↑ convection currents
- ↑ molybdenum
