هموگلوبین
هِموگلوبین (haemoglobin)
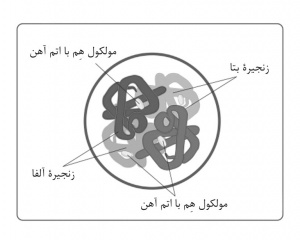
پروتئین لازم برای همۀ مهرهداران[۱] و برخی از بیمهرگان[۲]، برای انتقال اکسیژن. هموگلوبین و اکسیژن بهصورت برگشتپذیر ترکیب میشوند. در مهرهداران، در یاختههای قرمز خون (اریتروسیت[۳]ها) یافت میشود و به آنها رنگ قرمز میدهد. در ششها یا آبششها، که غلظت اکسیژن بالا است، اکسیژن به هموگلوبین میچسبد و اُکسی هموگلوبین[۴] تشکیل میدهد. این فرآیند به شکلی تأثیرگذار مقدار اکسیژنی را افزایش میدهد که وارد جریان خون میشود. سپس، اکسیژن در بافتهای بدن، یعنی جایی که غلظت اکسیژن پایین است، آزاد میشود و خون بدون اکسیژن به ششها و آبششها برمیگردد. هموگلوبین همچنین با مونواکسید کربن ترکیب میشود و بهصورت کربوکسی هموگلوبین[۵] درمیآید، اما در اینصورت واکنش غیرقابل برگشت است. طبق تحقیقی در امریکا (۱۹۹۶)، هموگلوبین در تنظیم فشار خون نیز نقش دارد. مولکول هموگلوبین مقدار کمی اسید آمینۀ سیستین دارد که با یونهای اکسید نیتریک (NO +) در خون پیوند برقرار میکند. اکسید نیتریک باعث استراحت ماهیچههای اطراف رگهای خونی میشود و به اتساع رگها و درنتیجه، کاهش فشار خون کمک میکند. هموگلوبین از دو زوج زنجیرۀ پروتئینی ساخته شدهاست که در خارج از یاختۀ خونی از هم جدا و سمی میشوند. در ۱۹۹۳، هموگلوبین را با کمک مهندسی ژنتیک و از طریق قراردادن الگوهای مصنوعی ژنها، که رمز این پروتئینها در باکتری ای کُلای[۶] هستند، ساختند و آنچنان آنها را تغییر دادند که زوجهای پروتئین بههم پیوستند و سمی نشدند.
