ژن درمانی
ژِندرمانی (gene therapy)
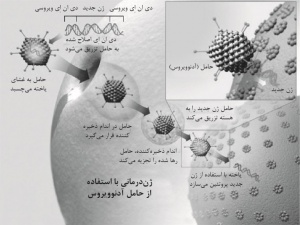
نوعی روش پزشکی، برای درمان یا برطرفکردن بیماریها یا نقایص ارثی ناشی از عملکرد نادرست ژنها، برخی از عفونتها، و چندین نوع سرطان. در این روش، یاختههای درگیر از بدن بیمار گرفته میشوند، دیاناِی آنها در آزمایشگاه ترمیم میشود (مهندسی ژنتیک[۱])، و یاختههایی که فعالیت طبیعی خود را بهدست آوردهاند، مجدداً به بدن بازگردانده میشوند. در ۱۹۹۰، برای اولینبار از یک ژن دستکاریشده برای درمان بیماری استفاده شد. در ۱۹۹۰، یک دختر امریکایی چهارساله، از بچههای معروف به بچههای حبابی[۲]، برای نخستینبار ژندرمانی شد. این دختر مبتلا به کمبود آنزیم آدنوزین دِآمیناز[۳] بود. این بیماری نوعی کمبود آنزیمی نادر است که باعث ضعف دستگاه ایمنی در مبارزه با عفونتها میشود، لذا این کودکان را باید در حبابهای عاری از میکروب بزرگ کرد و معمولاً در سنین پایین میمیرند (← نقص_ایمنی_شدید_مرکب[۴]). فیبروز کیستیک[۵] از شایعترین بیماریهای ارثی و ازجمله بیماریهایی است که مهندسان ژنتیک بیش از بقیه به آن توجه کردهاند. امریکا و انگلستان در درمان این بیماری پیشگام بودهاند. ژندرمانی راهحل نهایی برای بیماریهای ارثی نیست. این روش ممکن است بیمار را درمان کند، ولی مانع از انتقال نقص وراثتی به فرزندان او نمیشود. با این همه، ممکن است از این روش در درمان بیماریهای دیگر، ازجمله بیماریهای قلبی و برخی از سرطانها، استفاده کرد. پژوهشگران امریکایی توانستهاند با تفنگ ژنی[۶] بهشکل موفقیتآمیزی گروه خاصی از یاختههای بدخیم را هدف قرار دهند. در اواخر دهۀ ۱۹۹۰، با آنکه صدها نفر ژندرمانی شده بودند، هیچیک بهبودی نیافتند. حتی در کارآزماییهای کمبود آدنوزین دِآمیناز، که ژندرمانی برای درمان آن موفقیت بیشتری داشته است، هنور به کودکان آدنوزین دِآمیناز مصنوعی تزریق میشد و احتمالاً بخش عمدۀ بهبودی آنها ناشی از تزریقها بود. مرگ نوجوانی امریکایی، با نام جسی گلسینگر[۷]، حین کارآزمایی بالینی در ۱۹۹۹ مانع بزرگی در راه بهکارگیری این روش برای درمان بیماران شد. در ۱۹۹۳، پژوهشگران توانستند با ژندرمانی عملکرد طبیعی یاختههای شش موشهایی را که بهصورت مصنوعی به فیبروز کیستیک مبتلا شده بودند، بازگردانند. این موفقیت امید دستیابی به چنین روشی را برای درمان انسانها افزایش داد. درحال حاضر از رترو ویروس[۸]ها بهمنزلۀ حامل[۹] استفاده میکنند، ولی از آنجا که با این ویروسها نمیتوان بخش خاصی از کروموزوم را هدف قرار داد، آزمایشهایی برای استفاده از دو نوع ویروس، آدنوویروس[۱۰] و ویروس همراه آدنو[۱۱]، درحال اجراست. با استفاده از آدنوویروس نقص فیبروز کیستیک در حفرۀ بینی با موفقیت اصلاح شده است. ویروس همراه آدنو از ایننظر که محمولۀ ژنی[۱۲] خود را در ناحیهای خاص قرار میدهد و در انسان موجب بیماری نمیشود، اهمیت دارد. برخی از شرکتهایی که در زمینۀ فناوری زیستی[۱۳] فعالیت میکنند، از ویروسها استفاده نمیکنند. زیرا اعتقاد دارند که برخی از یاختهها دی اِن اِی را پس از تزریق به بدن جذب و طبق آن عمل میکنند و پژوهشها بر این اساس صورت میگیرد. استفاده از ناقلهای لیپوزومی[۱۴] برای واردکردن دی اِن اِی جدید یا تغییریافته به یاخته روشی بیخطر، ولی کمدقت است، زیرا این ناقلها محمولۀ خود را بهصورت یکسان به همۀ یاختهها، هدف و غیرهدف، وارد میکنند. ویروسهای ناتوانشده دقیقتر عمل میکنند، ولی ممکن است بار دیگر فعال و موجب بیماری شوند. به همین سبب، استفاده از آنها با مخاطراتی همراه است. در ۱۹۹۵، پژوهشهایی برای دستیابی به نوعی ناقل دقیق و بیخطر با استفاده از گروهی از ژنها، با نام ناحیۀ کنترل لوکوس[۱۵] یا السیآر شروع شد. در این پژوهشها، ژن درمانکننده به اِلسیآر متصل میشود. اِلسیآر بعد از ورود به یاخته و زمانی فعال میشود که با پروتئینهای مخصوصِ یاختههای هدفِ ژن درمانکننده تماس پیدا کند. در ۱۹۹۶، تلاشهایی برای درمان سرطان ریه در امریکا صورت گرفت که با موفقیت همراه بود. در نُه بیمار، که سرطانشان عود کرده بود، ژن پ ۵۳ که در بیش از ۵۰ درصد از سرطانها جهشیافته یا ازدست رفته است، مستقیماً به تومور تزریق شد. درپی تزریق، تومور در سه بیمار کوچک و رشد آن در سه بیمار دیگر متوقف شد.
